Das Coronavirus SARS-CoV-2 gelangt durch Membranfusion nach Kontakt seines Spikeproteins mit dem ACE2-Rezeptor in menschliche Zellen. Neue Studien belegen eine zweite Rolle des Proteins in COVID-19: das Verschmelzen von Körperzellen.
Ein Forschungsteam des Paul-Ehrlich-Instituts hat vielversprechende Assays entwickelt, mit denen sich diese Fusionen messen lassen. Schon geringste Mengen des Spikeproteins reichen in Zellkultur aus, infizierte und nicht infizierte Zellen verschmelzen und absterben zu lassen. Viruspartikel mit Spikeprotein auf ihrer Oberfläche können sogar nur durch Kontakt Zellen veranlassen, mit ihren Nachbarn zu fusionieren.
Fusion infizierter mit nicht infizierten Zellen
Das Spikeprotein S spielt eine wesentliche Rolle für die Ansteckungsfähigkeit (Infektiosität) des Coronavirus SARS-CoV-2 und den Infektionsverlauf (Pathogenität). Verschmolzene Zellen in den Lungen von an COVID-19 verstorbenen Patientinnen und Patienten lassen vermuten, dass das Spikeprotein von SARS-CoV-2 nicht nur den Zelleintritt des Virus selbst, sondern auch die Fusion infizierter mit nicht infizierten Zellen ermöglicht.
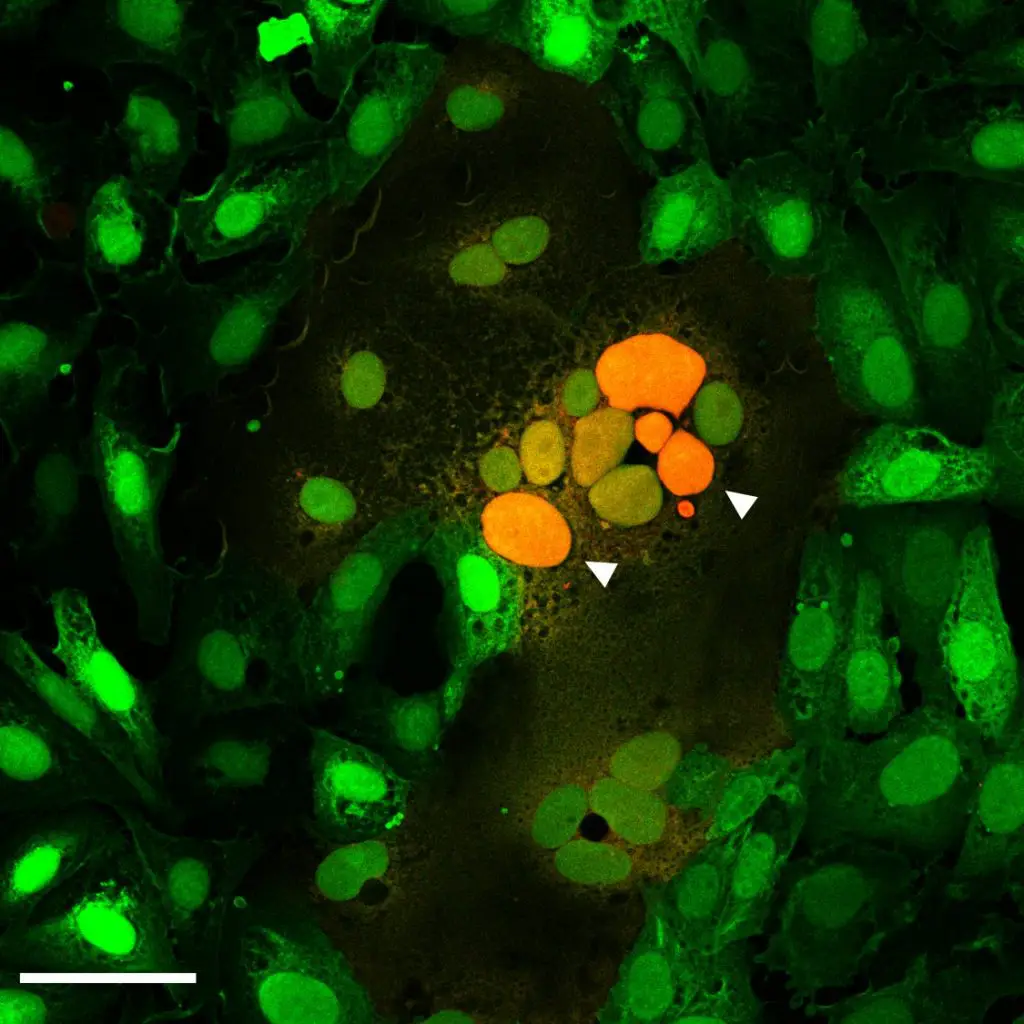
Ein interdisziplinär arbeitendes Forschungsteam am Paul-Ehrlich-Institut (PEI) um Prof. Christian Buchholz, Leiter der Forschungsgruppe „Molekulare Biotechnologie und Gentherapie“, untersuchte in Zellkultur, in welchem Umfang die durch das Spikeprotein vermittelte Membranfusion stattfindet. Hierzu entwickelte das Team Assays zur Quantifizierung der Prozesse. Sie basieren auf einer Methode, die bereits zur Quantifizierung der vom Humanen Immundefizienzvirus (HIV) vermittelten Zellfusion eingesetzt wurde. Dabei wird ein sogenannter „Reporter“, dessen Vorhandensein sich mithilfe chemischer Reaktionen nachweisen lässt, in zwei Teile (alpha und omega) zerlegt.
In der Zellkultur erhält ein Zelltyp das alpha-, der andere das omega-Fragment. Nur wenn die beiden Zelltypen fusionieren, entsteht durch Verbindung von alpha und omega der vollständige Reporter, der sich mit Durchflusszytometrie und Fluoreszenzmikroskopie nachweisen lässt. Unterstützt wurden die Befunde mittels Western-Blot.
SARS-CoV-2-Spikeprotein ist enorm fusionsaktiv
Wichtige Erkenntnis: Das SARS-CoV-2-Spikeprotein ist enorm fusionsaktiv: Selbst geringste, kaum mehr nachweisbare Mengen des Spikeproteins auf der Zelloberfläche reichen aus, um die Zellfusion und somit den Zelltod einzuleiten. Doch das Spikeprotein kann noch mehr: Es reicht der Kontakt von Viruspartikeln, welche das SARS-CoV-2-Spikeprotein auf ihrer Oberfläche tragen, mit menschlichen Zellen aus, dass diese miteinander fusionieren. Für die betroffenen Zellen kann die Fusion das Absterben bedeuten. Dieser als „fusion-from-without“ bezeichnete Prozess unterstreicht die enorme Membranfusionsaktivität des Spikeproteins.
Eine weitere Erkenntnis der Forschergruppe: Die Gabe des Serums inklusive der neutralisierenden Antikörper von Patientinnen und Patienten, die COVID-19 überstanden hatten, hemmte zwar sehr effizient die durch die Spikeproteine vermittelte Membranfusion von Viruspartikeln mit Zellen, nicht dagegen die Fusion von Spikeprotein tragenden Zellen untereinander.
Die starke Fusogenität, also die ausgeprägte Fähigkeit des SARS-CoV-2-Spikeproteins, die Fusion (das Verschmelzen) von Zellen auszulösen, könnte eine wichtige Rolle für die Pathogenität und das Andauern der Virusinfektionen spielen – beispielsweise bei Masern- und Herpesviren ist dies der Fall. Den Ergebnissen der Forschungsgruppe zufolge können neutralisierende Antikörper diese Fusionsprozesse möglicherweise nur bedingt beeinflussen.
„Die von uns entwickelten Methoden erlauben eine sehr sensitive Untersuchung der SARS-CoV-2 vermittelten Membranfusion. Sie können sowohl für die Grundlagenforschung als auch für das Screening von Wirkstoffen gegen COVID-19 genutzt werden. Ebenfalls ermöglicht wird ein Vergleich der Prozesse bei den verschiedenen SARS-CoV-2-Virusvarianten. Dies könnte einen wesentlichen Beitrag zum Verständnis dieser neuen Varianten und ihrer Pathogenität liefern“, erläutert Prof. Christian Buchholz die Bedeutung dieser Ergebnisse.
