Forschenden des Instituts für Biotechnologie und Bioprozesstechnik der TU Graz sowie des Austrian Centre of Industrial Biotechnology (acib) ist die Erzeugung des wichtigen mRNA Impfstoffbestandteil Pseudouridin mittels biokatalytischer Synthese gelungen.

Bernd Nidetzky, Martin Pfeiffer und Andrej Ribar haben damit eine Alternative zur bisherigen Methode der chemischen Synthese geschaffen.
Ein Prozessschritt genügt
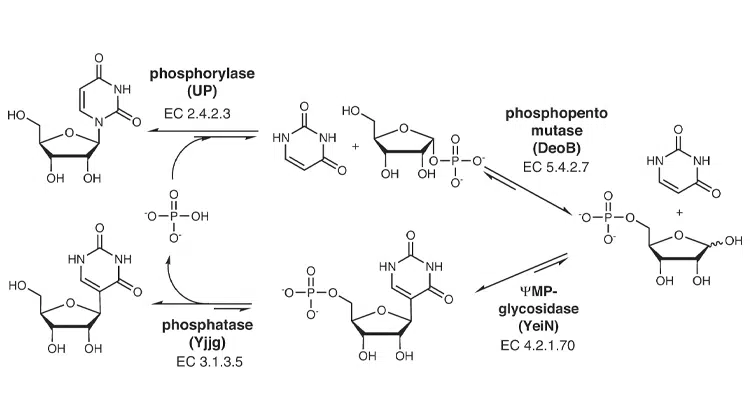
Bei der chemischen Synthese von Pseudouridin kommen toxische Reagenzien und seltene Rohstoffe zur Anwendung. Zudem ist sie aufgrund der notwendigen 4-8 Prozessschritte und der Kühlung auf minus 20 Grad sehr energie- und zeitaufwendig. Bei der Biokatalyse hingegen ist nur ein Prozessschritt mit vier parallellaufenden Reaktionen erforderlich, die bei Raumtemperatur stattfinden. Außerdem braucht es als Katalysatoren nur vier Enzyme (Uridin Phosphorylase, Phosphopentose Mutase, Pseudouridin Monophosphate Glycosidase, Phosphatase). Diese lassen sich recht einfach mit E.coli Bakterien hergestellen. Bei der Biokatalyse fallen auch keine Abfallstoffe an. Der einzige Abfall ist Phosphat, das aber während des Katalyseprozesses wieder rezykliert wird.
Ein weiterer gewichtiger Vorteil ist die Effizienz. Da bei der chemischen Herstellung von Pseudouridin, verkürzt gesagt, das für Impfstoffe weniger effiziente, natürlich vorkommende Uridin umgewandelt wird, gibt es während des Umwandlungsprozesses keine hundertprozentige Ausbeute. Mit der biokatalytischen Synthese gelingt aufgrund der geringeren Anzahl an Prozessschritten allerdings eine Ausbeute von 92 bis 95 Prozent, während es bei den bisher publizierten chemischen Prozessen gerade einmal 40 bis 50 Prozent sind.
Inspiration aus der Natur
Um dieses neue Verfahren zu entwickeln, haben die Forschenden auf eine ihrer früheren Studien aufgebaut, bei der sie das Enzym YeiN als Biokatalysator für die Herstellung von C-Nukleotiden entdeckt hatten. Da Pseudouridin das C-Nukleoside des RNA-Bausteins Uridin ist, hatten sie die Idee, das mittels bakterieller Fermentationen in großen Mengen herstellbare Uridin als Rohstoff zu nehmen und die Bindung zwischen dessen Grundbausteinen neu zu knüpfen. Die Inspiration dafür kam aus der Natur.

So hat Uridin, im Gegensatz zu Pseudouridin, eine N-glykosidische Bindung, die beim natürlichen Abbau in den Zellen mittels des Enzyms Uridin Phosphorylase in Ribose-1-phosphat (Zucker) und Uracil gespalten wird. Danach kommt das Enzym Phosphopentose Mutase zum Einsatz, welches das Ribose-1-phosphat zu Ribose-5-phosphat umlagert, das in den Zellen verstoffwechselt wird. Es folgt die Anwendung des YeiN-Enzyms, mit dem die Verknüpfung des Ribose-5-phosphats und des Uracils zu Pseudouridin-5-phosphat erfolgt. Mittels Phosphatase wird das Phosphat noch vom Pseudouridin abgespalten und man ist am Ziel. Da das Pseudouridin noch dazu wesentlich weniger wasserlöslich ist als Uridin, kristallisiert es im Laufe der Reaktion einfach aus und lässt sich daher unkompliziert durch Abfiltern des Reaktionsüberstandes gewinnen.
Pseudouridin Herstellung bald im größeren Maßstab
„Unsere Arbeit zeigt, dass die Biokatalyse eine potente Alternative zur chemischen Synthese von C-Nukleotiden wie Pseudouridin darstellt“, erklärt Bernd Nidetzky, der Leiter des Instituts für Biotechnologie und Bioprozesstechnik der TU Graz. „Wir hoffen, die Herstellung bald im größeren Maßstab umzusetzen und so Pseudouridin nachhaltig und billig in größeren Mengen zur Verfügung zu stellen. Das könnte mittelfristig eventuell auch die Herstellung von mRNA-Impfstoffen günstiger machen, da potenzielle Partner aus der Industrie unsere Anwendung recht zeitnah implementieren könnten.“
Originalpublikation:
Pfeiffer, M., Ribar, A. & Nidetzky, B. A selective and atom-economic rearrangement of uridine by cascade biocatalysis for production of pseudouridine. Nat Commun 14, 2261 (2023). https://doi.org/10.1038/s41467-023-37942-7